Catalisadores e inibidores
Você já ouviu falar em catalisadores e inibidores?
Sabe-se que em uma reação as moléculas seguem o caminho que oferece menor resistência, ainda que para fazer este caminho elas tenham que gastar um bocado de energia. Dessa forma, uma elevada energia de ativação faz com que a reação ocorra lentamente.
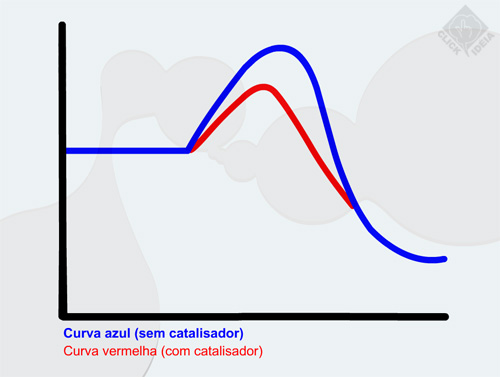
No entanto, o andamento de uma reação química pode ser modificado pela adição de compostos não-reagentes à mistura reacional. Esses podem alterar o caminho da reação, diminuindo a energia necessária para que ela ocorra. Um material capaz de realizar essa tarefa é chamado catalisador.
Assim, um catalisador age baixando a energia de ativação, o que permite que a reação ocorra por um novo caminho.
Dentre os exemplos de catalisadores, podem-se citar as enzimas que atuam em processos metabólicos e o conversor catalítico presente nos automóveis. Esse último é capaz de reduzir a emissão de poluentes atmosféricos.
Os catalisadores podem ser homogêneos ou heterogêneos, sendo que uma catálise homogênea é aquela que ocorre quando o catalisador e os reagentes constituem uma só fase (uma solução) e a catálise heterogênea é aquela na qual o catalisador e os reagentes constituem duas ou mais fases (sistema polifásico ou mistura heterogênea).
Os catalisadores heterogêneos apresentam uma vantagem em relação aos homogêneos: podem ser facilmente separados (por filtração, por exemplo) do meio reacional e reutilizados diversas vezes.
Como toda reação, as de catálise também podem ser descritas por um mecanismo, ou seja, uma hipótese baseada em resultados obtidos experimentalmente.
É importante enfatizar que o catalisador não é consumido durante a reação. Ele simplesmente acelera a reação possibilitando um caminho de menor energia para a transformação dos reagentes em produtos.
Assim, os catalisadores associam-se com as moléculas reagentes (também conhecidas como substratos) e provocam uma redistribuição de suas nuvens eletrônicas. Isto causa um enfraquecimento nas ligações que devem ser quebradas para que a reação ocorra. Quando o produto é formado, o sítio ativo é liberado e torna-se capaz de repetir todo o processo com uma outra molécula de reagente.
Se um aumento na temperatura faz com que as reações ocorram com velocidades maiores, para que usar um catalisador?
Nem sempre um aumento na temperatura de uma reação é prático. Por exemplo, para uma reação exotérmica pode ocorrer uma mudança no rendimento do produto. Em outros casos, causa a decomposição dos produtos, além de provocarem reações indesejáveis. Em tais circunstâncias, o uso de um catalisador é altamente recomendado.
O inibidor é usado para aumentar a energia de ativação da reação, fazendo com que ocorra mais lentamente do que o normal. Isto é desejável quando se quer preservar substâncias ou retardar reações de decomposição.
Observação MUITO Importante
Os catalisadores não alteram a posição de equilíbrio de uma reação química. Isso significa que a energia dos produtos obtidos é a mesma em uma reação catalisada e ou não-catalisada.
Para verificar se aprendeu o que foi abordado nessa página, clique na atividade interativa ao lado.